生物科技热门
 距离成为“理想载体”,外泌体还有多远的路要走
距离成为“理想载体”,外泌体还有多远的路要走
 红杉、高瓴、鼎晖重注的赛道,一家市值不到50亿的合成生物学潜力新星
红杉、高瓴、鼎晖重注的赛道,一家市值不到50亿的合成生物学潜力新星
 强势对战GSK,国内带状疱疹疫苗玩家能否制胜百亿赛道
强势对战GSK,国内带状疱疹疫苗玩家能否制胜百亿赛道
 国产正崛起!中国基因测序产业链图谱与市场分析
国产正崛起!中国基因测序产业链图谱与市场分析
 2022年将是全基因组测序临床应用的重要转折
2022年将是全基因组测序临床应用的重要转折
 Bio.完成2500万美元A轮融资,前百时美施贵宝公司肿瘤研究专家加入公司
Bio.完成2500万美元A轮融资,前百时美施贵宝公司肿瘤研究专家加入公司
 思珞赛生物TheraXyte完成逾千万美元Pre-A轮融资,多方位创新外泌体载药技术
思珞赛生物TheraXyte完成逾千万美元Pre-A轮融资,多方位创新外泌体载药技术
 Nature发文证实线粒体RNA修饰可促进癌症转移扩散!有望成为对抗癌症转移的新靶点
Nature发文证实线粒体RNA修饰可促进癌症转移扩散!有望成为对抗癌症转移的新靶点

推荐资讯
 让区块链变成人人可用的工具,上海原创Web3.0操作系统是如何诞生的
让区块链变成人人可用的工具,上海原创Web3.0操作系统是如何诞生的
 隐私之变|自我主张时代变革,从构建WEB3.0的ID体系开始
隐私之变|自我主张时代变革,从构建WEB3.0的ID体系开始
 被投资圈盯上,风头超过元宇宙,Web3.0到底是啥?
被投资圈盯上,风头超过元宇宙,Web3.0到底是啥?
 Web3.0,勾勒下一代互联网模样
Web3.0,勾勒下一代互联网模样
 为什么说中国汽车产业已经真正“支棱”起来了
为什么说中国汽车产业已经真正“支棱”起来了
 我在新能源汽车行业打工10年:从月薪2千涨至年薪40万,终于熬出头
我在新能源汽车行业打工10年:从月薪2千涨至年薪40万,终于熬出头
 对话梅宏院士:数字化转型不是想不想,而是必须转
对话梅宏院士:数字化转型不是想不想,而是必须转
 王兴继续“电商零售梦”:告别社区团购 美团优选变身明日达超市
王兴继续“电商零售梦”:告别社区团购 美团优选变身明日达超市

距离成为“理想载体”,外泌体还有多远的路要走
来源:药智网/卜芥
新冠疫情爆发,催生了mRNA技术的快速发展。目前,全球RNA疗法主要集中在临床前和早期临床阶段。RNA疗法要想得到广泛普及,必须要克服的一关便是有效递送系统的建立,以解决RNA治疗分子的早期降解、毒性和非靶标特异性等问题。
递送载体作为RNA等基因疗法的关键,主要分为病毒载体和非病毒载体两大类。病毒载体中,AAV(腺相关病毒载体)应用较为广泛,但免疫原性高,不能重复给药。合成脂质纳米颗粒(LNP)一直是基因疗法的主要递送装置,不过它们会在人体中引起毒性免疫反应。尽管设计已有所改进,LNP递送系统大多靶向肝脏,肝脏以外器官的有效递送问题亟待解决。此外,在稳定性、递送效率、靶向性方面,仍有很多提升空间。
因此,寻找新型有效递送载体成为基因疗法发展的关键。外泌体凭借其独特优势,闯入人们的视野。
外泌体的发现历程
外泌体是由细胞主动分泌、大小均一的囊泡样小体,最早发现于体外培养的绵羊红细胞上清液中。当时科学家们发现这种小囊泡可将细胞生长发育过程中不必要的蛋白质从一个细胞携带至另一个细胞,由此断定小囊泡是细胞代谢的“垃圾”。随着研究的深入,1987年,麦吉尔大学生化系教授Johnstone将小囊泡命名为“exosomes”(外泌体)。2013年,经过近30年的探索,外泌体在细胞间运输调控的机制被进一步深入挖掘,美国科学家James E. Rothman、Randy W. Schekman及德国科学家Thomas C. Südho因此共同获得2013年诺贝尔生理医学奖。
外泌体的组成及生物学功能
具体来说,外泌体是一种磷脂双层囊泡,它由完整的磷脂双分子层所包裹,内含丰富的DNA和RNA、脂质、代谢产物、胞质蛋白等。

外泌体的组成(图源:Science)
外泌体起源于细胞内囊泡和早期内体的融合,早期内体又形成包含腔内囊泡(ILVs)的多泡体(MVB)。然后一些MVBs与质膜(PM)融合将ILVs释放到细胞外环境即为外泌体。精确调节外泌体分泌对于正常的细胞间通讯至关重要。外泌体通过三种主要途径进入细胞:与靶细胞的膜融合、由受体-配体相互作用驱动的内化以及内吞作用。
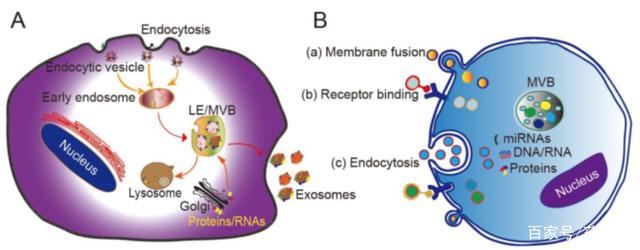
外泌体的生物发生、分泌和细胞进入
(图源:Engineeringexosomes for targeted drug delivery)
越来越多的证据表明,外泌体在细胞间远距离通讯中起着至关重要的作用,因为它们可以通过循环系统到达其他细胞与组织,产生远程调控作用,而且具有穿过屏障(如细胞质膜、血脑屏障和胃肠道)的能力。因此,人们对外泌体的功能及其作为小分子治疗载体的潜在应用产生了极大的兴趣。
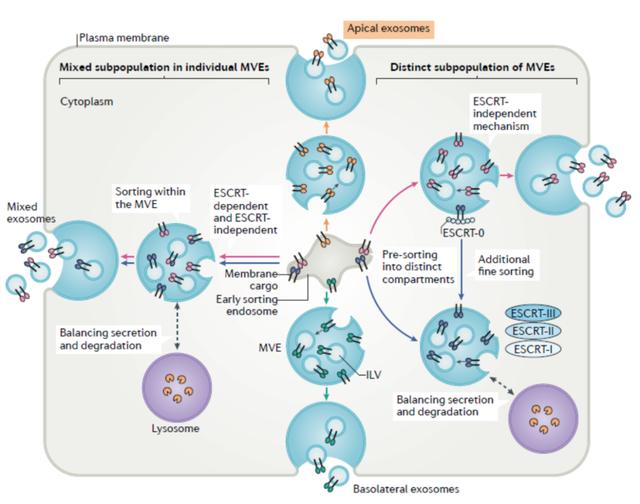
外泌体递送及作用原理
(图源:Shedding light on the cell biology of extracellular vesicles)
先天优势助力外泌体成为“理想载体”
机体内大多数细胞在正常及病理状态下均可分泌外泌体,得天独厚的结构使它们成为细胞中的“快递员”,可将各种各样的生物大分子在细胞间进行转运。作为一种递送方式,它具有显著的先天优势:
首先,外泌体具有脂质双分子结构,可以有效包装疏水性和亲水性药物,其表面的肽可以与靶细胞上的受体特异性结合,从而加速外泌体在靶组织中的积累。此外,外泌体本身内含多种有效成分,因此可以负载的药物成分类型非常丰富,包括小分子、核酸和重组蛋白等。其次,由于外泌体是内源性物质,没有免疫原性,因此安全性高。
另外,外泌体可以循环至人体所有的腔室,具有比较好的组织选择性,而且可透过血脑屏障,能够完成对中枢神经系统的药物递送。最后,可以对外泌体进行复杂的工程化改造,通过基因或者化学等方式,对外泌体的成分以及生物学功能进行调控,从而能够更好的服务于我们的治疗目的。
以上种种优势,都使外泌体被认为是理想的药物递送载体。相关领域的研究迅速成为热点,国内外有关外泌体的转化研究更是如火如荼。
资本热捧,“外泌体递送”成新宠
由于发现外泌体在药物递送方面所展现的亮眼优势和巨大开发前景,多家制药巨头纷纷进场入局,以大手笔布局外泌体递送技术。
2018年7月,罗氏与PureTech Health达成合作,计划利用PureTech的乳源外泌体平台技术,为罗氏的反义寡核苷酸平台开发口服配方的核酸类药物。在此合作协议中,PureTech Health将获得超过10亿美元的里程金及特许权使用费。
2019年1月,爵士制药(Jazz Pharmaceuticals)与Codiak BioSciences达成超10亿美元策略合作协议,协议双方将针对五个不同靶标的候选外泌体治疗方案,共同研究、开发和商业化。
Codiak Biosciences是外泌体治疗的领先企业,利用其特有的engEx平台,Codiak可以对具有不同特性的外泌体进行工程改造,为它们加载各种类型的治疗分子,使它们到达特定的细胞靶标。Codiak目前产品管线包括肿瘤、神经系统治疗等多领域。
2020年3月,武田制药(Takeda)与Evox Therapeutics达成8.82亿美元的交易,主要将利用Evox的DeliverEX外泌体递送技术,共同开发五项针对罕见病的疗法。
Evox是一家专注于利用和改造外泌体的自然输送能力,开发全新的生物疗法的公司。该公司开发的DeliverEX技术平台可以设计和修饰外泌体,并将药物装载到外泌体中靶向运送到目标器官,包括中枢神经系统和其他药物传递技术无法触及的细胞和组织。
2020年6月,礼来也与Evox Therapeutics达成了一项12.3亿美元的合作协议,希望应用Evox的DeliverEX外泌体递送技术,开发装载siRNA和反义寡核苷酸外泌体治疗药物,用于治疗神经系统疾病。
2021年5月,Reyon Pharmaceuticals和MDimune公司达成协议,共同开发基于外泌体递送的病毒疫苗和罕见遗传疾病的mRNA疗法。据协议,双方将利用MDimune公司专有的BioDrone技术平台负责递送mRNA。
2021年10月,基于人工智能的RNA精准医疗的中国公司NeoCura也和MDimune公司达成合作协议,共同开发基于外泌体递送癌症疫苗的mRNA疗法。
国内目前有恩泽康泰、艾赛生物、唯思尔康、贝格尔生物等企业在外泌体递送赛道布局。
其中恩泽康泰是国内最早一批聚焦外泌体领域的生物科技公司,恩泽康泰建立了高效的外泌体工程化改造平台,并具备成熟的规模化外泌体量产及高纯度分离能力。通过工程化改造的方式对外泌体进行改性,大幅提高了外泌体携带特定有效成分的能力。
艾赛生物开展了外泌体载药平台研究,并在外泌体载药平台研究拥有多项独立知识产权,专利囊括了外泌体分离存储、外泌体靶向修饰、外泌体制剂制备等适用性广、实用性强的专有技术。
唯思尔康作为国内外泌体领域的后起新秀,刚成立即获得亿元天使轮融资资金,由元生创投、联想之星、北极光创投、博远资本等多家知名投资机构联合参与。目前,借助天使轮融资资金,唯思尔康正在进行外泌体平台的搭建,为外泌体新药研发奠定基础。
贝格尔生物作为一家生物技术创新企业,现已建成完备的外泌体富集和内含生物标记物的提取与分析平台,公司致力于血液病和神经退行性疾病领域,进行外泌体技术研究和临床应用转化。
值得注意的是,当前国内外泌体药物仍处于初级阶段,尚无一家公司有产品进入临床。
外泌体递送技术面临的挑战
虽然,外泌体递送药物已成为目前研究的热点,但仍存在临床应用限制。
首先,获取天然的纯外泌体比较困难,但外泌体纳米囊泡的制备为该问题的解决提供了方法。虽然外泌体纳米囊泡在结构和功能上与天然外泌体相似,但外泌体来源广泛,各种来源的外泌体是否均能得到外泌体纳米囊泡、其结构的完整性是否会遭到破坏、各方面生理活性是否均与天然外泌体相同等问题仍有待于进一步研究。
其次,虽然靶向性修饰方法已在实验中取得了进展,但人体内环境复杂,所修饰的外泌体进入体内后是否仍具备预期的靶向性尚不确定,因此对于外泌体的靶向性修饰仍然是有待攻克的重点。
最后,GMP级药用外泌体的生产仍然是行业一大挑战,工艺的持续优化会是一个长期的过程。
作为天然的细胞间信息载体,外泌体因其纳米级尺寸、生物相容性、通透性和低免疫原性等优点,成为了研究人员开发药物运输载体的理想对象之一。根据Grand View Research 2018年初的研究报告,全球外泌体整体市场规模在2030年将达22.8亿美元。目前全球有近50家企业积极布局外泌体这一赛道,包括罗氏、武田、礼来在内的多家制药巨头。不过对国内药企有利的是,当前外泌体行业还处于早期萌芽阶段,制药巨头在研发上并无明显优势。当前海外外泌体相关临床研究均处于I期,对于国内初创企业不会形成先发优势。因此,国内药企拥有巨大的发展机遇。
更多相关内容
-
北京公司的燃油车指标牌照转让费用及流程介绍
北京公司的燃油车指标牌照转让费用及流程介绍 韩冷锋15301056225 我们都知道,现在北京的公司燃油...
-
转让一家50万注册资金的公司带北京车指标牌照
转让一家 50 万注册资金的公司带北京车指标牌照 韩冷锋15301056225
-
钒电池概念爆发,行业发展迎机遇
近日,国家能源局综合司发布的《防止电 力生产事故的二十五项重点要求(2022年版)(征求意见稿)》提出...
-
收购北京50万小规模公司带1个车指标转让
收购北京50万小规模公司带1个车指标转让 I88拨ll47打0405 姚经理因市场需求量紧缺指标少需求大的...
-
转让北京公司带3个车指标转让公司干净无经营
转让北京公司带3个车指标转让公司干净无经营 I88拨ll47打0405 姚经理 带北京车指标的公...
-
在北京注册人力资源服务公司需要多少钱
在北京注册人力资源服务公司需要多少钱 李轩洁 I89II744O94 近年来各个行业都在迅速发展,行业之间...
-
收购北京中字头的投资公司如何办理变更手续
收购北京中字头的投资公司如何办理变更手续 李轩洁 I89II744O94 目前金融环境非常的糟糕,加上监管...
-
中国广电政企经营|解读广电集客现状与拓展
摘要 昨日,中国广电政企业务经营体系咨询服务项目中选候选人公示。 据悉, 广电运营商拓展集...
-
京东安装“小红书”
“可颂”上线不到三天,就被媒体狂轰滥炸为字节跳动的“心病”。 相比而言,京东一个月前客户端大改版则...
-
比亚迪称霸日本!高管亲自站台:电动巴士市占率已达70%
现在的比亚迪,不仅在国内的新能源汽车销量火爆,在国外也同样如此。其生产的电动巴士,早在前几年就已...
推荐阅读











